中国NMPAに対する医療機器の該非判定について、類似品(競合他社含む)情報があれば当局のデータベースからある程度判断する事が可能です。
ただ、中国国内でも類似品がない製品については、弊社でもNMPAへ正式に該非判定の申請が可能です。
申請書は弊社にて作成いたしますが、下記の資料のご提出をお願いしています。
まずは今お持ちの書類で申請が可能かお問い合わせください。
1. 中文取説
2. 製品の写真(カタログや取説で確認出来ればOK)
3. 製品に適用された安全規格一覧
4. 日本の認証・承認書、EC Cert. やアメリカ510(k)の登録情報
医療機器に該当する場合、競合他社の登録製品情報も合わせてご案内が可能です。
フィリピンPFDAによると、審査段階にある80,000件程度の申請について、4,000件程度の申請案件の処理(登録、又は却下)が完了したと報告しています。
PFDA当局は、今後“迷惑な申請”が慢性化されないよう規制・要求事項を更に強化します。
その強化策の一つとして、一定期間中に必要な資料・情報を提出出来ない製造業者の申請を自動的に却下します。
PFDAはこの強化策によってより短期間での審査・登録が可能になることを目指しています。
(インドネシアのように、完成度の高い申請書作成が短期間での登録実現に必要不可欠となります)
詳細は弊社のニュースレターでもご案内いたします。
ニュースレターをご希望の方はこちらからお申し込みください。
<欧州ノーティファイドボディ(NB)の状況>
-約30(全体の半数程度)のNBがMDR/IVDRに対し申請
-年内にMDR/IVDRの資格を得るNBが出る可能性(?)
<イギリスのNB>
BSI 2018年11月中にオランダで新たにNBとして資格
SGS 既にフィンランドとベルギーにオフィス
UL、LRQA 加盟国の規制当局へアプローチ中
<移行期間>
ある一定条件を満たすことで免除される仕組み
-認証証の有効期限の延長措置
-特定の機器に対する厳しい臨床試験の要求免除措置
<注意>
※上記の情報は不確定な情報を含みます。
※規制やNBの状況は日々変わりますので、常に最新の規制、ガイダンス、NBの情報を参照してください。
※上記の情報によって生じたいかなる損害、問題についてはクアルテック・ジャパン及びクアルテック・グループは一切の責任を負いかねます。
先週はマレーシアにてAHWPの年次総会2018が開催されました。
(内容については来たる12月21日(金)に大阪府立男女共同参画・青少年センター(ドーンセンター)にてOMETA様主催セミナーにてご報告がございます)
このタイミングで商談も兼ねてマレーシアへ行かれた企業様も多かったのではないでしょうか。
また、来月にはドイツにてMEDICAが開催されます。
https://www.medica-tradefair.com/
マレーシアにおいて、主に展示会等の臨床用途ではない製品の持ち込み方法について質問がございましたので、下記までご連絡いたします。
主に下記の5つの目的で製品を持ち込む場合には製品登録が免除されています。
EXEMPTION FROM REGISTRATION OF MEDICAL DEVICES
1. The purpose of demonstration for marketing マーケティング活動向けのデモンストレーション
2. The purpose of education 教育目的
3. The purpose of clinical research or performance evaluation of medical device 臨床研究、性能評価
4. A Custom-Made Medical Device; or カスタムの医療機器
5. A Special Access Medical Device 特別な目的をもつ医療機器
免除申請書の内容を確認する事により、具体的な内容を確認することが出来ます。
1.の申請書では、「Trade show, fair or exhibition」と記載されていますので、マーケティン活動向けのデモンストレーションは展示会も含みます。
台湾TFDAは非薬用歯磨き粉、マウスウォッシュを化粧品法の中で規制する予定と発表しました。
医療機器同様に申請関連費用も高くなる予定です。
弊社は医療機器登録を専門としておりますが、台湾の化粧品登録も行なっております。
登録に必要な試験代行も可能です。
原文:
マレーシアMDAは9月末に2つの検索用ページを公開しました。
自社製品や競合製品、登録法人検索に大変便利です。
1)Registered Medical Device Search
製品、登録番号、代理人、有効期間などの情報検索が可能です。
2)Licensed Establishment Search
下記は弊社の登録情報となります。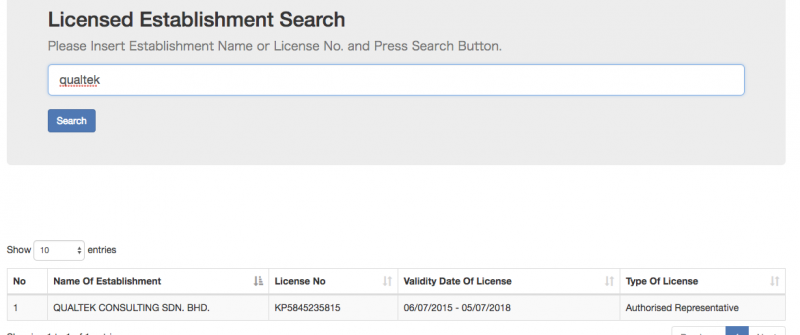
来たる12月21日(金)、大阪にてOMETA様主催セミナー開催が決定いたしました。
セミナー概要は下記となります。
別途、OMETA様よりセミナーの正式なご案内がございます。
4)につきましては、弊社でもご質問の多い(今更聞けない)内容となりますので、是非この機会にご参加ください。
2)の弊社セミナーについて、聞きたい内容などがございましたら、下記よりご連絡ください。
セミナーの中で出来る限り解説できるように準備いたします。
このメールアドレスはスパムボットから保護されています。閲覧するにはJavaScriptを有効にする必要があります。
++++++++++++++++++++++++++++++++++++++++++++++
1) AHWP年次総会参加報告
2) ASEAN規制のアップデート (弊社にて)
3) ISO13485:2016と改正QMS省令
4) 厚生労働省 医療機器証明書の発給申請のポイント
+++++++++++++++++++++++++++++++++++++++++++++++
MDAは2016年6月30日以前に医療機器の登録申請を行い、2018年10月5日までに登録が完了しない申請案件については、登録システムから削除(Drop)されるという通知を出しました。
※削除された機器の申請は再度MEDCASTを通して新規申請する事は可能です。
台湾のTFDAは2019年7月1日より医療機器の新規登録申請や変更申請に関する新料金表を発表しました。
詳細は下記の原文をご確認ください。
衛授食字第1071605900號附件草案總說明及逐條說明.pdf
運営コストの増加に伴う見直しとなっています。
弊社にてサポートさせていただいている他のアセアン諸国も申請費用の見直しが進んでいます。
度々ご質問をいただく為、改めて下記までご説明いたします。
GC111111111111
G: General Medical Device
C: Class C (Classification of Medical Device)
数字: ランダムに発行される番号
弊社は先日 EUノーティファイドボディからMDRに関するトレーニングを受けました。
2020年に向け一段と規制が厳しくなる中、ノーティファイドボディの減少もその要因の一つとして欧米の医療機器メーカーのアジア・アセアン展開が今後益々加速する事が予想されています。
実際、その兆候は既に出ており、他社より1日でも早く製品登録されたい企業様の対応に追われています。
アセアン版のAMDDについては2020年の実現は難しいという噂が飛び交う中、規制のハードルが低い国への製品登録は現地ディストリビューターと関係を早期に築く上でも「将来を見据えた先行投資だ」と殆どの欧米企業は口を揃えて言います。
さて、これまでクラスI機器としてMDDで自己宣言されていた企業様について、MDRの影響として臨床データの取り扱い、要求について心配されている企業様が多くいらっしゃいます。臨床評価報告書の対応は中国CFDAでもその独自要求に基づきハードルが一気に高くなりました。
弊社では臨床試験チームにより、特に非能動のハイリスク機器について多くの臨床評価報告書作成経験と実績があり、欧州のRev.4対応に向けた臨床評価報告書作成サービスも既に開始しています。
これまでノーティファイドボディによる臨床評価報告書の監査を受けられた事のないクラスI機器のメーカー様で既存の臨床評価報告書の見直しをご検討の場合、是非お問い合わせください。
このメールアドレスはスパムボットから保護されています。閲覧するにはJavaScriptを有効にする必要があります。
現在、HSAは製品登録の際に求められる電気安全性試験のエビデンスとして IEC60601-1 第2版、第3版両方を受け入れています。
時期は未定ですが、HSAによると今後は第三版のみの受入とする予定です。
日本国内では2019年2月末が経過措置期間となっていますので、同じような時期になるかもしれません。
3版対応で設計変更が発生し国内販売を中止される場合でも、シンガポールへ製品登録される企業様はご注意ください。
弊社は2018年中にタイのサービス開始を目標に準備を進めています。
現在、クアルテック・グループの100%出資子会社ではなく、協力企業(弊社の台湾本社出資の現地ディストリビューター)の名前で許可申請、現地法定代理人サービスをスタートしています。
現地ディストリビューター名での輸入許可となりますが、弊社のタイ・オフィスがスタート次第、許可の移管も可能です。
このディストリンビューターは弊社の出資も受けており、取扱製品は美容整形関係の機器を専門としていますので、競合製品を取り扱うディストリビューターに比べ安心ですし、許可移管の際もスムーズに対応が可能です。
タイ市場への製品登録、代理人関するご質問がございましたら、お気軽にお問い合わせください。
中国における市場抜き取り検査に関する要求は2015年に発行された下記が適用となっています。
近年、中国市場では製品の抜き取り検査が強化されています。
その目的の一つとして、適切な変更管理が出来ていない場合、市場対応等が求められることになります。
変更申請の要否について、正確な判断は登録申請時の書類を確認し、必要に応じて当局へ確認する必要があります。
弊社へ変更申請の要否に関するご質問をいただく際にも、申請関連文書一式をお送りいただき確認いたします。
市場抜き取り検査や更新申請時に大きな問題に発展しないよう、日頃より登録管理を確実にしてください。
シンガポール HSAは 2018年8月1日付、新規・変更申請等の費用を見直し、新たな価格表を発表しました。
大幅な引き上げではありませんが、増加傾向にある業務コストがその理由と発表しています。
尚、新価格は2019年4月2日以降の適用となります。
他のアセアン諸国の申請費用はシンガポールに比べるとまだ低い状況ですが、審査業務に対応するリソースの確保、トレーニング費用等をカバーするため、今後見直し(増加)が加速する可能性があります。
製品ラベルの要求事項は各国で異なります。
例えば、法定代理人や輸入者情報の要否、またはその両方が不要で製品オーナー(多くの場合、日本の製造販売業者様)情報だけでもよい国もあります。
メーカー様では少なくとも下記の3点を考慮いただき、ラベルの最終確定をお願いしたいと思います。
+++++++++++++++++++++++++++++++++++++++++++++++++++++++
1. 法定要求事項を満たす
最低限満たす必要のある要求
これで十分ではない可能性がある!
2. リスクマネジメント
上記1に加え、リスク低減策として記載すべき内容が増える可能性
3. 規制当局の要求
上記1、2に加え、審査の過程で審査担当者がラベルに追加記載を求める可能性
+++++++++++++++++++++++++++++++++++++++++++++++++++++++
結論として、ラベルの最終確定には下記を念頭に置き製品登録完了まで柔軟に対応いただくことがポイントとなります。
1)規制要求事項を満たすだけでは十分でない可能性があること
2)申請時のラベル案から製品登録までに修正を求められる可能性があること
2008年、2015年に引き続き、弊社台湾本社はTFDAの臨床試験に対するGCP査察合格いたしました。
(2018年は韓国の医療機器メーカー様の臨床試験が監査対象となりました)
英文となりますが、下記の通りフェイスブック、Linkedinでも情報を公開していますので、ご参考までご確認ください。
FB:
Linkedin:
- https://www.linkedin.com/feed/update/urn:li:activity:6424480976226869248/
- https://www.linkedin.com/feed/update/urn:li:activity:6424482068750790656/
今週7/6(金)に開催されますOMETA様主催の海外医療機器セミナー2018について、会場がTPK九段下神保町ビジネスセンターへ変更となりました。
セミナーに参加いたします弊社スタッフ:
Dr. Chang, Qualtech Consulting Corporation 代表
Irene Lu, Qualtech Consulting Corporation グローバル製品登録部 マネージャー
Sally Guo, Qualtech Consulting Corporation 北京オフィス CFDA、臨床試験業務 責任者
Patty Tsao, Qualtech Japan Consulting Corporation 日本 ビジネスコーディネーター
中国の国務院 司法部は今週に現行の規制制度を改定する法案のドラフトを発表しました。
7月24日まで意見募集を行い、主な内容は下記の4点となります。
弊社7月のニュースレターでもご案内いたします。
1)ライセンスホルダーのシステム強化
2)臨床試験システムの改革
3)審査と登録システムの最適化
4)市販後管理要求の改善
具体的な内容;
1. 第二類の国産医療機器の登録がCNDAへ
2. ライセンスホルダーに対する義務の追加
3. 臨床評価文書の要求事項に対する変更
4. 医療機器の固有番号のシステム導入
5. 製造業者が外部試験所の試験報告書を提出できる仕組み
6. 市販後管理の強化
7. 罰金の増額











