タイ
タイ タイFDAはリスククラスに応じた製品登録制度を正式に開始
去る2021年2月15日、タイFDAは新たなリスククラス(1, 2, 3, 4)に基づく製品登録制度を正式にスタートいたしました。
これまでのPolicyベース(クラスIII, II, I)による製品登録制度からASEANの4分類に基づく制度への大きな変更となります。
新しい制度では医療機器はリスクの低いクラス1(Listing MD)からクラス2、3(Notified MD)、4(Licensed MD)に分類されます。
現在、新制度による登録制度で採用される1)Pre-submission, 2)E-submission のガイダンスはドラフト段階ですが、発表されている審査日数はクラス1でも200営業日となっています。
また、クラス1は2021年3月17日より、クラス2, 3, 4の機器は2021年2月15日から新法による申請(新規)が求められます。
新法による登録の流れはこちらもご参考にして下さい。
タイ クラス1, 2, 3, 4の医療機器に対するCSDT検査を実施
タイFDAは、登録済みの医療機器に対するCSDT検査実施の新たな通知を発表しました。
クラス1, 2, 3の医療機器について2021年6月21日から実施され、クラス4は2021年9月11日となります。
期日までにタイFDAからのCSDT検査に向けCSDT文書を完成させておく必要がございます。
※弊社が法定代理人のお客様につきましては、通知原文(参考英訳)をご案内いたします。
Notified/Licensedの医療機器輸入許可をお持ちの場合、既にCSDTで審査を受けられていると思いますが、General Medica Device (クラスIII)の医療機器メーカー様はご準備が必要です。
タイ Thai FDA訪問、 新法強制化の時期について
本日、タイFDAを訪問し様々なトピックに対する意見交換を行いました。
新法の強制化について、ハイリスクの製品から段階的に強制化していく方向で進んでいます。
弊社も随時最新情報をホームページとMonthly ニュースレターにてご案内して参ります。


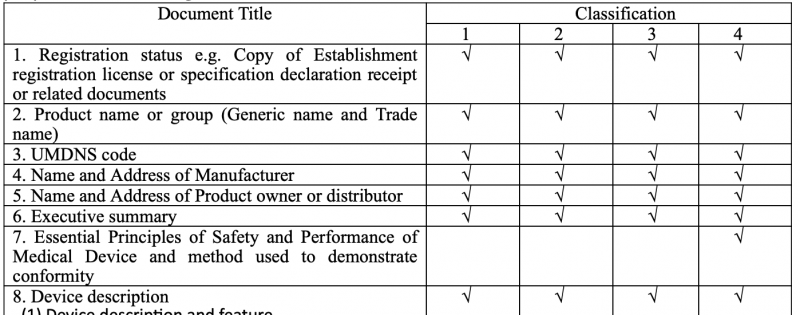
タイ FDA医療機器のクラス分類と製品リスト一覧
|
Category |
Class 1 |
Class 2 |
Class 3 |
|
Description |
MD to be licensed |
MD to be notified |
General MD to be applied import license |
|
Products listed |
|
|
Device not listed under classes 1 & 2 (90% of all applications) |
タイ Thai FDA 輸入許可、製品登録サービスの流れ
来年1月中を目標にクアルテック タイオフィスはImporter Establishment License取得し製品登録と法定代理人サービスを開始いたします。
タイFDAへの製品登録に関する登録の流れを更新いたしましたので、ご参考までご確認ください。
http://www.qualtech.co.jp/images/thaifda2018.12.pdf
タイ ThaiFDAサービスに向けバンコクに現地法人を設立
弊社はタイへの医療機器の輸入許可(Import License)、AseanMDDへ向けた規制強化に対応に向けクアルテック・タイ法人を設立しました。
正式なサービス開始は来年1月を予定しています。
年内には弊社ホームページでもサービス案内等の情報を更新いたします。
タイ 輸入許可申請、現地法定代理人サービス
弊社は2018年中にタイのサービス開始を目標に準備を進めています。
現在、クアルテック・グループの100%出資子会社ではなく、協力企業(弊社の台湾本社出資の現地ディストリビューター)の名前で許可申請、現地法定代理人サービスをスタートしています。
現地ディストリビューター名での輸入許可となりますが、弊社のタイ・オフィスがスタート次第、許可の移管も可能です。
このディストリンビューターは弊社の出資も受けており、取扱製品は美容整形関係の機器を専門としていますので、競合製品を取り扱うディストリビューターに比べ安心ですし、許可移管の際もスムーズに対応が可能です。
タイ市場への製品登録、代理人関するご質問がございましたら、お気軽にお問い合わせください。
タイ ThaiFDAはAMDDの受け入れを表明
タイのFDAは3月にAMDDの受け入れを正式に表明し、AMDDに沿ったクラス分類のシステム採用が決まっています。
今年の1月よりタイFDA(TFDA)はAMDDやGDMPDに関するセミナーを開催していますが、今後更に通知等が発行される予定です。
原文ではAMDDに沿った”Medical Device Act” として、クラス分類の制定、輸入品の管理・監視、広告の規定、罰金の制定、登録・申請費用の改定(高くなる)等が記載されています。
弊社は2018年後半にタイに拠点を置く計画です。
新たな通知等は最新ニュースや弊社のMonthly News(要登録)にて発信して参ります。
Monthly Newsは下記よりご登録ください。
http://www.qualtech.co.jp/member.html