このたび、当社の株主構成の一部に変更がありましたのでご報告いたします。
今回の変更は、経営体制のさらなる強化、中長期的な成長と安定を目的とし、代表者、事業内容、サービス提供体制に変更はございません。
また、6月にはホームページのリニューアルと新サービスのご案内を予定しております。
今後とも、これまでと変わらぬご支援を賜りますようお願い申し上げます。
クアルテック・ジャパン・コンサルティング株式会社
代表取締役 村山 剛
来る2025年3月21日(金)に神戸ポートアイランドにて、9月にタイで行われるアジア最大級の医療機器展示会Medical Fair Thailandの共同出展公募説明会が開催されます。
弊社ではタイの医療機器薬事規制について情報提供を行います。
詳細・お申し込み
https://www.fbri-kobe.org/kbic/event/detail.php?event_id=826
過去のセミナー
2025年4月8日(火)にNPO海外医療機器技術協会様(OMETA)主催セミナーが開催されます。
欧州MDRに関する内容となります。セミナープログラム、お申し込みは下記の開催案内をご確認ください。
謹んで新春のお慶びを申し上げます。
旧年中は格別のご厚情を賜り、心より感謝申し上げます。
本年、私どもの本社は設立25周年を迎えることとなりました。
これもひとえに皆様のご支援とご愛顧の賜物と深く感謝しております。
この記念すべき年を迎え、さらなる発展を目指し、グローバルな視点で新たな挑戦を進めて参ります。
私たちは、これからもお客様の信頼にお応えできるよう、社員一同一層の努力を続けて参りますので、何卒変わらぬご支援を賜りますようお願い申し上げます。
最後になりましたが、皆様のご健勝とご多幸、そしてますますのご発展を心よりお祈り申し上げます。
本年もどうぞよろしくお願い申し上げます。
令和七年 元旦
クアルテックジャパンコンサルティング株式会社
村山 剛

お客様各位
休業期間中にいただいたお問い合せ等は、2025年1月6日(月)以降のご回答となります。
ご不便をおかけいたしますが、何卒よろしくお願い申し上げます。
<夏季休暇のお知らせ>
誠に勝手ながら、以下の日程を夏季休暇とさせて頂きます。
【夏季休暇:2024年8月10日(土)~ 8月15日(木)】
期間中に頂いたお問い合せ等は、2024年8月16日(金)以降のご回答となります。
ご不便をお掛け致しますが、何卒宜しくお願い申し上げます。
2024年9月6日(金)にNPO海外医療機器技術協会様(OMETA)主催セミナーが開催されます。
弊社よりインド、フィリピン、オーストラリアの規制アップデートをご案内いたします。
セミナー概要とお申し込みは下記の開催案内をご確認ください。
開催案内_OMETA_Qualtech_Webinar_2024.pdf
2024年11月以降、政府調達に関連する医療機器については下記のスケジュールにて医療機器登録、またはリスティング申請が完了したエビデンスが求められます。
1) 2024年11月1日以降、クラスII, III, IVの医療機器、またはクラスB, C, Dの体外診断用医療機器が対象
※登録された医療機器を優先的に採用
2) 2025年以降はすべての医療機器が対象となる可能性
<関連リンク>
経済産業省 海外医療機器規制レポート〜新興国等の医療機器規則に関する基本情報〜
医療機器規制レポート
https://healthcare-international.meti.go.jp/search/detail/10106/
フィリピンFDAは、今月3月31日をその申請期限と定めていましたクラスB, C, Dの医療機器CMDNの申請期限を2024年9月30日まで延期いたしました。
This issuance shall apply to all Class B, C and D medical devices that are not included in the list of registrable medical devices based on FC No. 2020-001-A.
お客様各位
休業期間中にいただいたお問い合せ等は、2024年1月4日(火)以降のご回答となります。
ご不便をおかけいたしますが、何卒よろしくお願い申し上げます。
来る2023年10月30日(月)にNPO海外医療機器技術協会様主催セミナーが開催されます。
弊社よりインドネシア、タイ、ベトナム、中国の規制アップデートをご案内いたします。
プログラム(予定)
■14:30-15:20
Medical Device Regulation Update
インドネシア、タイ、ベトナム、中国
■15:20-15:30
事前質問の解説
■15:30-16:00
MDR PSUR(定期的安全性最新報告)の最新情報
■16:00-16:30
厚生労働省医療機器証明書「よくある質問と解説」
※お申し込みは下記よりお願いいたします。
<夏季休暇のお知らせ>
誠に勝手ながら、以下の日程を夏季休暇とさせて頂きます。
【夏季休暇:2023年8月11日(金)~ 8月15日(火)】
期間中に頂いたお問い合せ等は、2023年8月16日(水)以降のご回答となります。
ご不便をお掛け致しますが、何卒宜しくお願い申し上げます。
2023年7月6日(木)の午前10時から17時まで、オンラインにて台湾医療機器規制のセミナーを開催いたします。
お申し込み、セミナー詳細は下記にてご確認ください。
https://www.tuvsud.com/ja-jp/services/training/ac/medical/open-schedule/taiwan
マレーシアMDAは申請関連の文書が不完全な状態で申請された新規、更新、変更申請について、その指摘から30営業日以内に完全な申請書類を揃えて提出することを2023年4月1日以降の申請に対し求めます。
※申請済の新規、更新、変更申請については2023年5月1日までに回答すること
30日以内に完全な申請書を揃えて提出出来ない場合には、その申請は却下され申請費用等の返金はなく、再度新規申請が必要となります。
<原文>
不完全な申請書類の審査には非常に時間がかかります。
本通知により、より完全性の高い申請書が提出される事でMDAの審査負担軽減、また、許可までのリードタイム短縮につながることを願います。
ベトナムMoHは2023年3月3日付、現行のDecree 98/2021の一部を改正する Decree 07/2023を施行しました。
主な内容は下記となります。
1)2018年1月1日以降発行された輸入許可(General Medical Device, IVD)は2024年12月31日まで有効
2)輸入許可が不要な医療機器(医療機器の消毒関連製品以外)は2024年12月31日までクラス分類の確認書(Classification Confirmation Letter)を取得することで輸入可能
3)2022年1月1日以前に申請された輸入許可申請は審査が継続され、発行された輸入許可は2024年12月31日まで有効
4)CSDTは2024年1月1日以降に適用。
5)製品登録申請(クラスC, D)の指摘事項に対する回答チャンスは最大3回まで。
去る2023年2月20日、CMDE(Center for Medical Device Evaluation)は技術審査の指摘事項に対する回答期間について、コロナ優遇措置を終了する内容を発表しました。
■2023年2月20日以降に発行された技術審査の指摘に対する回答期限:1年以内
■2023年2月20日以前に発行された技術審査の指摘に対する回答期限:1年 + 1年の延長(コロナ優遇) = 2年以内
参考リンク(原文)
去る2022年11月、MDAは医療機器の変更申請に関するガイダンスMDA/GD/0020第4版を発行しました。
EUのMDR、IVDR移行に伴う変更が含まれ、ラベリング変更などについて更新されています。
CHANGE NOTIFICATION FOR REGISTERED MEDICAL DEVICE (mda.gov.my)
マレーシアMDAは2022年11月にMDAから医療機器のラベリング要件に関するガイダンスMDA/GD/0026の第6版を発行しました。
※第5版から少し変更されています。
REQUIREMENTS FOR LABELLING OF MEDICAL DEVICES (mda.gov.my)
※主な変更点は下記の通りです。
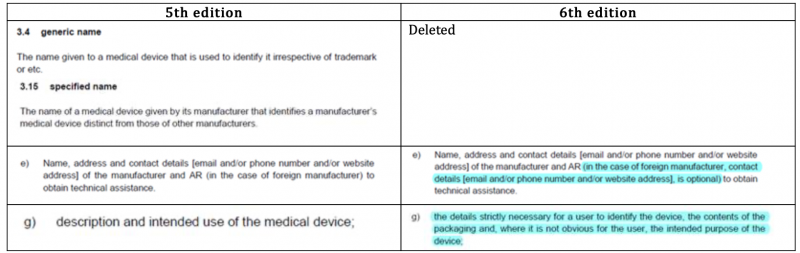
※アップデートされた箇所には、左端に縦線マークがついています。