中国
中国 NMPA 製品登録の更新申請・行政審査の回答期限等に関する通達を発表
世界的なコロナウイルスの影響により、NMPAは医療機器の登録業務に関連する重要な通達を発表しました。
<原文>
器审中心关于落实《市场监管总局 国家药监局 国家知识产权局支持复工复产十条》有关事宜的通告(2020年第7号)
https://www.cmde.org.cn/CL0004/20517.html
1. NMPA更新登録申請の期限に対する猶予
2. NMPA更新登録申請に際し型式試験、臨床試験等の遅延に対する猶予
3. NMPA行政審査の照会事項等に対する回答期限の猶予
中国 NMPA CMDEセンターでの申請関連受付業務に関する通知
武漢におけるコロナウイルスの影響を受け、CMDEセンターでの申請受付等の対応について2020年1月30日付、正式な通知が出ました。
主な内容:
-2020年2月3日以降、CA Certificateがある申請者様は、基本オンラインでの申請を求める
-書面関連の書類提出は全て郵便を求める
-受付窓口(Pre-review、審査に対する回答関係)はClosedとなる
-毎週木曜に開催される面談も一旦中止となる
<原文>
https://www.cmde.org.cn/CL0004/20403.html?from=groupmessage&isappinstalled=0
中国 NMPAが最新の臨床試験免除リストを更新
2019年12月20日にNMPAは臨床試験免除リストを正式に更新・発表いたしました。
下記リンクより最新リストをご確認ください。
http://www.nmpa.gov.cn/WS04/CL2138/372288.html
本免除リストの正式発表を待たれていた製造業者様にとっては、中国NMPA登録のハードルが一段下がった事になります。
中国 Sunmax社のコラーゲン・インプラントの登録取得
本日発行の弊社ニュースレターにて通知させていただきました通り、弊社はSunmax社のコラーゲンインプラントのNMPA登録を取得いたしました。
中国の医療機器登録は年々難しくなっており、弊社の対応しているアジア、アセアン各国の製品登録の中でも期間、費用共に製造業者様に一番負担が大きい国となっています。
多くの欧米の製造業者様が中国への医療機器登録へ積極的にチャレンジされる中、弊社も日本の医療機器メーカー様の製品をこれまでの経験と実績でサポートして参りますので、お気軽にご相談ください。

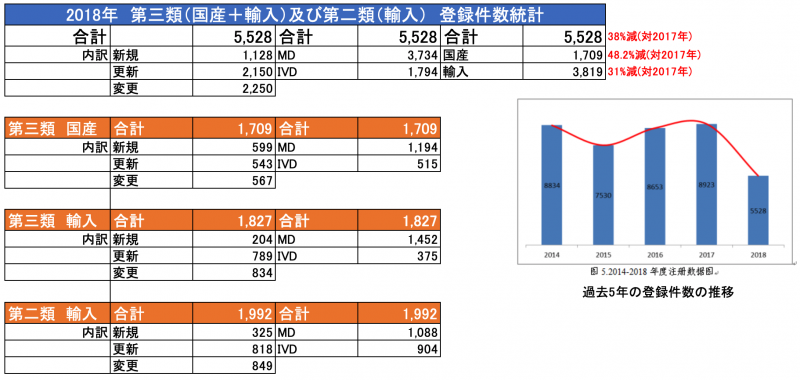
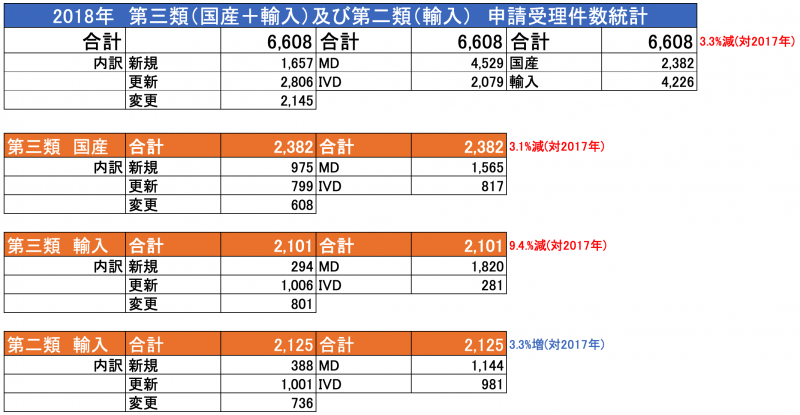
中国 NMPAは2018年度の登録業務に対する報告書を発表
2019年5月31日付、中国NMPAは2018年度の登録申請に関する報告書を発行しました。
主な内容は下記となります。
1. 眼科用超音波診断装置を含む技術審査の為の53のガイドライン発表
2. 外国の臨床試験データ受け入れのガイドライン発表
3. 臨床試験免除リスト改定(現在1254品目が免除リスト)
4. 革新的医療機器登録手順の改定
5. 国産医療機器の登録審査期間の短縮
6. 104の業界標準(YY)、10の国家標準(GB)を修正
2018年末時点 1399の業界標準、219の国家標準があり、国際規格と90%以上整合
7. 医療機器分類カタログを改定
8. 臨床試験に対する管理監督として2回のGCP検査実施
カプセル内視鏡含む20の申請案件に対し現地検査実施
http://www.nmpa.gov.cn/WS04/CL2056/338093.html
※第二類、第三類の申請・登録件数の統計データは別途ご案内いたします。
中国 NMPA申請向け外国での立会い試験開始
中国NMPA申請に向けた試験では、外国メーカーの登録申請においては中国国内の指定された試験所での試験実施が求められます。
この度弊社では外国での立会い試験として、永久据え置き型・腫瘍の治療装置に対する立会い試験をアレンジいたしました。
約2週間の期間で安全、EMC、性能試験を実施いたします。
今週より中国試験所の試験官、弊社北京オフィスのスタッフが製造メーカー様の工場を訪問し試験をスタートしています。
特定の条件を満たす製品・装置のみ、外国での試験が認められ、その試験レポートを使ってNMPAへ申請が可能です。
弊社では既に欧州のメーカー様でも立会い試験の実績がございます。
大型の装置は測定項目が多かったり、操作が煩雑であったり、試験準備に時間がかかったりと試験期間が長期化する傾向があります。
審査途中で再試験が求められると更に時間がかかります。
この点でも、立会い試験のメリットも大きいものがございますので、立会い試験が出来るのか確認したい、又は将来検討されたい企業様はお気軽にお問い合わせくださいませ。
中国 NMPA登録試験に向けたGB規格等の国内試験実施
中国NMPA登録申請には、現地の認められた試験所での試験(主に安全、EMC、性能)が求められます。
中国は安全、EMCともに国際規格の旧版での評価・試験を求めており、欧州対応等で最新規格で試験を実施されている企業様にとって、申請機器の適合性は気になるポイントとなっています。
国際規格と整合したGB規格以外に国家規格YY等も適用される場合、申請機器の設計等が適合するかも出来るだけ早く知っておくべき重要なポイントです。
この度、SGSジャパンが中国NMPA申請に向けたGB規格等を国内で事前評価、試験**を実施出来るサービスを開始されました。
また、SGSジャパンの国内試験所は医療機器規格の試験業務に力を入れており、既に下記の範囲で認定を取得しています。
1. IAS/ILAC MRA
https://www.iasonline.org/wp-content/uploads/2017/06/TL-761-Scope.pdf
※JIS規格に対する英文試験報告書発行も可能
2. CB認証
https://www.sgsgroup.jp/ja-jp/news/2017/11/safetylaboratoryieceecbtlnov2017
※最新の認定範囲はIECEEのホームページでご確認ください。
3. NRTLプログラム
https://www.osha.gov/dts/otpca/nrtl/sgs.html
お問い合わせは このメールアドレスはスパムボットから保護されています。閲覧するにはJavaScriptを有効にする必要があります。 または このメールアドレスはスパムボットから保護されています。閲覧するにはJavaScriptを有効にする必要があります。まで。
**NMPA登録の試験ではございません。
※NMPA:National Medical Products Administration
中国 NMPA電気医療機器に対する現地試験の工数・費用について
現在、多くの国内企業様はIEC60601-1第三版の試験報告書のみをお持ちです。
ただ、中国への製品登録申請で求められる規格はIECの第二版ベースとなっています。
第三版の試験報告書のみをお持ちの企業様の現地試験では、試験工数が多くなり試験費用も高くなります。
試験所へ試験を申し込む際、申込書に下記のようなチェック項目があります。
□二版のレポート有り
□三版のレポート有り
既にIEC第二版ベースの試験を実施される企業様は多くないかもしれませんが、二版の試験報告書があれば中国ではまだ活用できます。